Cosa sono i metalli?
I metalli sono una vasta categoria di elementi chimici che si trovano principalmente nella parte sinistra e centrale della tavola periodica. Sono conosciuti per alcune caratteristiche comuni, come la capacità di condurre elettricità e calore, la lucentezza metallica, e la possibilità di essere modellati, estesi e battuti senza rompersi (malleabilità e duttilità).
Un metallo è un elemento che tende a perdere elettroni e formare cationi (particelle cariche positivamente), in contrasto con i non metalli, che tendono a guadagnare elettroni.
Questo comportamento deriva dalla bassa elettronegatività dei metalli, ovvero la loro tendenza a trattenere debolmente gli elettroni nei legami chimici.
In natura, i metalli si trovano spesso sotto forma di minerali e composti, e possono essere estratti e lavorati per ottenere forme pure. L’impiego dei metalli è antichissimo, con prove di utilizzo del rame e del ferro che risalgono a migliaia di anni fa.

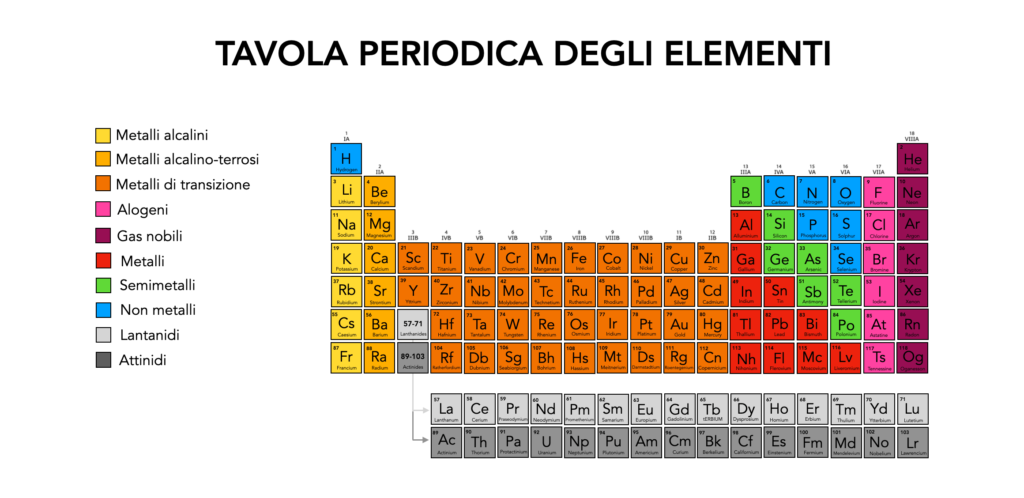
Dove si trovano i metalli nella tavola periodica
I metalli sono distribuiti in diverse sezioni della tavola periodica. Si trovano principalmente nella parte sinistra e al centro, con una distribuzione ben definita:
- Metalli alcalini: Prima colonna (Gruppo 1). Sono i metalli più reattivi, come il sodio (Na) e il potassio (K). Reagiscono facilmente con acqua e aria.
- Metalli alcalino-terrosi: Seconda colonna (Gruppo 2), come il magnesio (Mg) e il calcio (Ca). Anch’essi molto reattivi, ma meno rispetto agli alcalini.
- Metalli di transizione: Dal Gruppo 3 al 12. Sono i metalli più “comuni” come il ferro (Fe), il rame (Cu) e l’oro (Au). Questi elementi mostrano una vasta gamma di proprietà chimiche e fisiche.
- Lantanidi e attinidi: Serie separate spesso poste al di sotto della tavola periodica principale. Gli elementi di queste serie includono il lantanio (La) e l’uranio (U), utilizzati in tecnologia nucleare e magneti speciali.
In generale, si può osservare un gradiente da metalli reattivi (a sinistra) verso metalli meno reattivi e non metalli (verso destra) nella tavola periodica.
Tutti i metalli nella tavola periodica
Ecco una panoramica delle principali categorie di metalli nella tavola periodica:
Metalli alcalini: Litio (Li), Sodio (Na), Potassio (K), Rubidio (Rb), Cesio (Cs), Francio (Fr). Si trovano nel gruppo 1 e sono estremamente reattivi, soprattutto con l’acqua.
Metalli alcalino-terrosi: Berillio (Be), Magnesio (Mg), Calcio (Ca), Stronzio (Sr), Bario (Ba), Radio (Ra). Gruppo 2, meno reattivi rispetto agli alcalini, ma ancora in grado di reagire con l’acqua, seppur lentamente.
Metalli di transizione: Sono i metalli dal gruppo 3 al 12, tra cui troviamo ferro (Fe), rame (Cu), zinco (Zn), oro (Au) e argento (Ag). Questi metalli mostrano una grande varietà di proprietà, incluse quelle magnetiche, catalitiche e di conduzione elettrica.
Lantanidi e attinidi: Sono noti come metalli delle terre rare e comprendono elementi come il neodimio (Nd) e l’uranio (U), utilizzati rispettivamente in magneti ad alte prestazioni e reattori nucleari.
Esempio di come si legge un elemento della tavola periodica
Capire come interpretare un elemento nella tavola periodica è essenziale per comprendere le sue proprietà chimiche. La tavola periodica organizza gli elementi in base al loro numero atomico (che rappresenta il numero di protoni nel nucleo di un atomo) e le loro proprietà.

Prendiamo come esempio l’Oro (Au):
- Simbolo: Au
- Numero atomico: 79 (significa che ha 79 protoni e 79 elettroni)
- Peso atomico: circa 197.0 u
- Gruppo: 11 (fa parte dei metalli di transizione)
- Periodo: 6 (indica il numero di strati di elettroni attorno al nucleo)

Il numero atomico è fondamentale per determinare la posizione di un elemento, ma anche per capire quanti elettroni circondano il nucleo, e quindi le sue caratteristiche chimiche, come la capacità di formare legami con altri elementi.
Metalli, non metalli e semimetalli: la differenza
La distinzione principale tra metalli, non metalli e semimetalli risiede nelle loro proprietà fisiche e chimiche.
I metalli sono elementi chimici caratterizzati da proprietà fisiche come l’elevata conducibilità elettrica e termica, una superficie lucente e la capacità di essere malleabili (ossia modellabili in fogli sottili) e duttili (ossia estendibili in fili). I metalli, come il rame (Cu) o l’alluminio (Al), hanno la capacità di perdere elettroni, formando ioni positivi (cationi) e creando legami metallici o ionici. Questi legami conferiscono ai metalli resistenza meccanica e li rendono ideali per l’uso in strutture o sistemi elettrici. La loro natura altamente reattiva in certi contesti fa sì che formino composti, come ossidi o idrossidi, quando esposti all’ossigeno o all’acqua.
I non metalli, al contrario dei metalli, non sono buoni conduttori di elettricità o calore e tendono a essere fragili e opachi allo stato solido, come nel caso dello zolfo (S) o del fosforo (P). La caratteristica principale dei non metalli è la loro elevata elettronegatività, che significa che tendono a guadagnare elettroni quando formano legami chimici, formando ioni negativi (anioni). Questa tendenza li rende chimicamente opposti ai metalli. I non metalli sono presenti principalmente nell’emisfero destro della tavola periodica e svolgono ruoli essenziali in processi biologici e chimici, come l’ossigeno (O) nell’aria o il carbonio (C) nelle strutture organiche.
I semimetalli, o metalloidi, rappresentano una categoria intermedia tra i metalli e i non metalli. Gli elementi come il silicio (Si), il boro (B) o l’arsenico (As) presentano una combinazione di proprietà metalliche e non metalliche. Ad esempio, sono conduttori di elettricità, ma in modo meno efficiente rispetto ai metalli, caratteristica che li rende perfetti per l’uso nei semiconduttori in elettronica. Allo stesso tempo, i semimetalli hanno proprietà meccaniche simili ai non metalli, come la fragilità, e possono formare sia legami metallici che covalenti, in base alle condizioni chimiche. La loro posizione nella tavola periodica è vicina alla linea diagonale che separa i metalli dai non metalli, e questo riflette la loro natura ibrida.
Caratteristiche e proprietà dei metalli
Vediamo ora le principali proprietà dei metalli.
- Stato fisico: solido
La maggior parte dei metalli è solida a temperatura ambiente, a eccezione del mercurio, che è liquido. Questa proprietà di essere prevalentemente solidi deriva dalla forza dei legami metallici che tengono insieme gli atomi in un reticolo ordinato.
- Aspetto e colore: metallico, spesso lucente
I metalli hanno un aspetto metallico e lucente, caratterizzato da una superficie che riflette la luce in modo brillante. Metalli come l’alluminio e il ferro mostrano tipicamente una colorazione argentata o grigiastra, mentre altri, come l’oro (giallo) e il rame (rossastro), hanno tonalità distintive. Questo aspetto dipende dalla struttura elettronica dei metalli, che consente agli elettroni di assorbire e riflettere la luce in modi diversi, conferendo loro il caratteristico aspetto lucente.
- Lucentezza metallica: brillante
La lucentezza è una proprietà caratteristica dei metalli, che riflettono la luce grazie alla disposizione ordinata degli atomi e agli elettroni liberi sulla superficie. Questo rende i metalli esteticamente attraenti e comunemente utilizzati per superfici decorative e gioielli, come nel caso dell’oro e dell’argento.
- Massa e densità: elevata
La densità dei metalli varia significativamente: metalli come il piombo e l’osmiridio sono molto densi, mentre altri, come il litio, sono piuttosto leggeri. Questo rende i metalli adatti a usi diversi, dalle strutture pesanti alle leghe leggere utilizzate in aerospaziale.
- Duttilità e malleabilità: straordinaria
I metalli possono essere deformati senza spezzarsi. La duttilità permette di trasformarli in fili sottili, mentre la malleabilità consente di appiattirli in lamine. Queste proprietà sono dovute alla capacità degli atomi metallici di scorrere l’uno sull’altro senza interrompere i legami. Il rame, ad esempio, è ampiamente usato in questo modo.
- Punto di fusione: alto
I metalli hanno generalmente un punto di fusione elevato, con eccezioni come il mercurio. Ad esempio, il ferro fonde a 1538 °C, mentre il tungsteno ha uno dei punti di fusione più alti, a 3422 °C, il che li rende utili per applicazioni che richiedono resistenza alle alte temperature, come i componenti di forni e lampadine.
- Conducibilità elettrica e termica: eccellente
I metalli sono ottimi conduttori di elettricità e calore grazie agli elettroni liberi nel loro reticolo cristallino. Questi elettroni si muovono facilmente, permettendo la trasmissione di energia termica ed elettrica, motivo per cui materiali come il rame e l’alluminio sono usati nei circuiti elettrici e nei sistemi di riscaldamento.
- Reattività chimica: variabile
Alcuni metalli, come il sodio e il potassio, sono altamente reattivi e reagiscono velocemente con acqua e ossigeno, mentre altri, come l’oro e il platino, sono molto meno reattivi e resistono alla corrosione.
Questa variazione nella reattività dipende dalla loro posizione nella tavola periodica e dalla struttura elettronica.
Struttura atomica dei metalli
Le proprietà e le caratteristiche uniche dei metalli, come la conduzione elettrica e termica, la duttilità e la malleabilità, derivano direttamente dalla loro struttura atomica. Gli atomi metallici sono disposti in uno schema ordinato chiamato reticolo cristallino, che si ripete nelle tre dimensioni, conferendo ai metalli le loro particolari qualità meccaniche e fisiche.
Struttura atomica e legame con gli elettroni: i legami metallici
Nei metalli, gli atomi sono legati tra loro tramite un tipo di legame chiamato legame metallico.
In questo tipo di legame, gli elettroni di valenza – ossia gli elettroni presenti nel livello energetico più esterno dell’atomo – si muovono liberamente attraverso il reticolo cristallino, creando una sorta di “nuvola” di elettroni.

Questa “nuvola di elettroni” circonda i nuclei atomici positivi, permettendo agli atomi di scorrere l’uno sull’altro senza rompersi, motivo per cui i metalli sono così malleabili e duttili. Gli elettroni di valenza, essendo liberi di muoversi, sono anche la ragione della loro eccellente conducibilità elettrica e termica.
Principali schemi di reticolo cristallino nei metalli
I metalli possono assumere diverse strutture cristalline, che determinano alcune delle loro proprietà meccaniche, come la durezza e la resistenza. Le tre strutture più comuni sono:
Cubo a corpo centrato (CCC)
In questa configurazione, gli atomi sono disposti ai vertici di un cubo, con un atomo posizionato esattamente al centro del cubo. Questo tipo di reticolo conferisce al metallo una buona resistenza meccanica, anche se non è particolarmente duttile. È tipico del ferro (Fe) a determinate temperature e del tungsteno (W), elementi che necessitano di elevate resistenze meccaniche.
Cubo a facce centrate (CFC)
Nella struttura CFC, gli atomi si trovano ai vertici del cubo e al centro di ciascuna delle sei facce del cubo. Questa disposizione rende il metallo particolarmente duttile e malleabile, come avviene nel rame (Cu), nell’alluminio (Al) e nell’oro (Au). Metalli con questa struttura sono spesso utilizzati per fili elettrici e fogli metallici grazie alla loro capacità di deformarsi senza rompersi.
Esagonale compatta (EC)
Nella struttura esagonale compatta, gli atomi formano un reticolo in cui gli strati di atomi sono disposti in un pattern esagonale tridimensionale. Questo schema offre una combinazione di resistenza e leggerezza. È comune nel magnesio (Mg) e nel titanio (Ti), che vengono utilizzati in leghe leggere e in applicazioni aerospaziali per la loro elevata resistenza e basso peso.
Come distinguere rapidamente metalli e non metalli: la regola di Sanderson
La regola di Sanderson è uno strumento semplice ma efficace per distinguere metalli e non metalli nella tavola periodica, basandosi su un concetto chiamato elettronegatività.
L’elettronegatività è la capacità di un atomo di attrarre a sé gli elettroni quando forma un legame chimico. In generale, gli elementi con bassa elettronegatività tendono a comportarsi come metalli, mentre quelli con elevata elettronegatività agiscono come non metalli.
La regola suggerisce che:
Metalli: si trovano nella parte sinistra della tavola periodica e hanno una bassa elettronegatività, il che significa che tendono a cedere elettroni facilmente per formare legami ionici o metallici.
Non metalli: sono posizionati a destra nella tavola periodica e hanno una elevata elettronegatività, quindi tendono a guadagnare elettroni formando legami covalenti.
Utilizzando l’elettronegatività come guida, Sanderson ha proposto una semplice regola che permette di fare una distinzione abbastanza accurata tra metalli e non metalli semplicemente osservando la loro posizione nella tavola periodica.
Per esempio, elementi come il fluoro (F) o l’ossigeno (O), che si trovano a destra, sono chiaramente non metalli per via della loro elevata elettronegatività. Al contrario, elementi come il sodio (Na) o il ferro (Fe), situati più a sinistra, sono metalli poiché cedono elettroni più facilmente.




