L’argento: metallo, caratteristiche e Tavola Periodica degli Elementi. Ecco uno dei metalli più affascinanti e utilizzati nella storia dell’umanità, noto per la sua elevata conducibilità, la brillantezza inconfondibile e le sue proprietà antibatteriche.
A proposito di argento, in questo articolo trovi:
- Posizione nella tavola periodica
- Significato della posizione: gruppo e riga
- Come leggere le caratteristiche atomiche
- Proprietà fisiche e chimiche
- Storia e curiosità sull’argento
Argento: cos’è e come appare
L’argento è un metallo di transizione dal colore bianco-lucente e dall’aspetto brillante. È un elemento chimico con simbolo Ag e numero atomico 47, appartenente al gruppo 11 della tavola periodica.
Pur essendo meno abbondante rispetto ad altri metalli, l’argento si trova in natura sia allo stato nativo che combinato con altri elementi, formando minerali come l’argentite e la cerargirite.

La sua duttilità e malleabilità lo rendono facilmente lavorabile, mentre la sua elevata conducibilità elettrica e termica lo rendono un materiale fondamentale in elettronica, gioielleria e applicazioni industriali avanzate.
Caratteristiche principali dell’argento
L’argento possiede caratteristiche uniche che lo rendono indispensabile in molti settori. Le approfondiremo più avanti, ora elenchiamo le principali.
- Stato fisico: solido, brillante e bianco-lucente
- Resistenza alla corrosione: moderata, ma ossidabile in presenza di zolfo
- Reattività chimica: medio-bassa
- Conduttività: massima tra tutti i metalli
- Densità: relativamente elevata rispetto a molti altri metalli comuni
- Duttilità e malleabilità: facilmente lavorabile e modellabile
- Capacità di formare leghe: eccellente predisposizione a legarsi con rame, oro e altri metalli

| Simbolo Chimico | Ag |
| Numero Atomico | 47 |
| Gruppo | 11 (Metalli di transizione) |
| Periodo | 5 |
| Blocco | d |
| Conducibilità Elettrica | Eccellente |
| Colore | Bianco lucido |
| Massa Atomica | 107,87 u |
| Densità | 10,49 g/cm³ |
| Punto di Fusione | 962 °C |
| Punto di Ebollizione | 2.162 °C |
| Stato Fisico | Solido a temperatura ambiente |
| Resistenza alla Corrosione | Alta, ma più suscettibile rispetto all’oro |
| Configurazione Elettronica | [Kr] 4d¹⁰ 5s¹ |
| Elettronegatività | 1,93 (scala di Pauling) |
| Raggio Atomico | 144 pm |
| Energia di Ionizzazione (1ª) | 731 kJ/mol |
| Affinità Elettronica | 125,6 kJ/mol |
L’argento nella Tavola Periodica degli Elementi
Ecco dove si trova l’argento nella tavola periodica degli elementi e il significato della sua posizione.
L’argento si trova nella tavola periodica nel gruppo 11 (precedentemente noto come gruppo IB) e nel periodo 5. Fa parte dei metalli di transizione, una categoria di elementi noti per la loro elevata conducibilità, la capacità di formare leghe e la stabilità chimica.
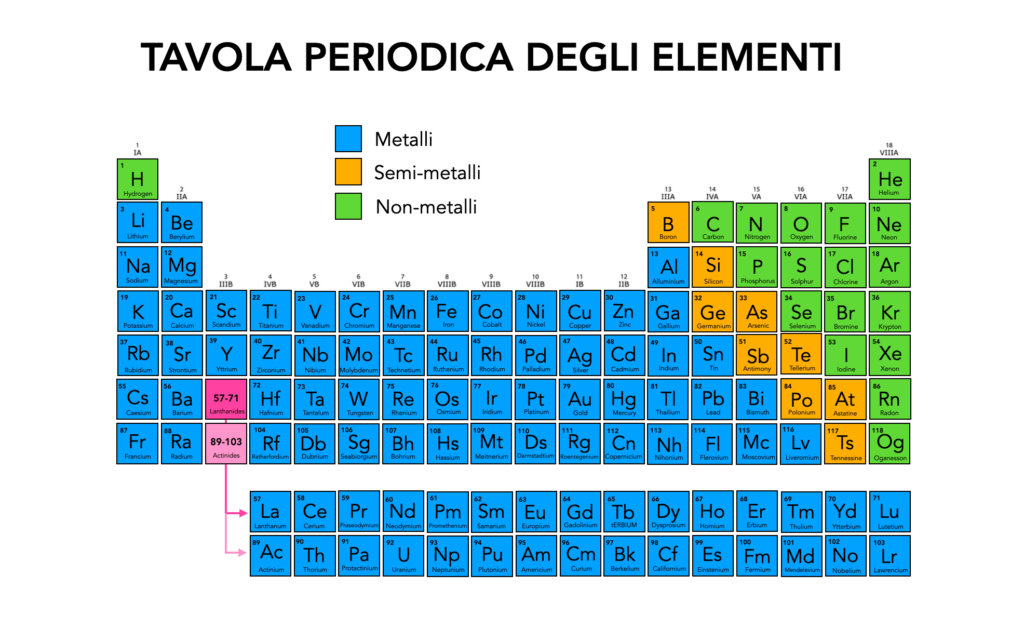
Appartiene alla stessa famiglia del rame (Cu) e dell’oro (Au), con cui condivide diverse proprietà chimiche, come la tendenza a formare composti poco reattivi e l’ottima conduttività elettrica. La posizione dell’argento nella tavola periodica riflette la sua struttura elettronica stabile e il suo comportamento chimico relativamente nobile, che lo rende resistente alla corrosione in condizioni normali.
L’argento, in particolare, si caratterizza per:
- Alta conducibilità elettrica e termica: è il miglior conduttore tra tutti i metalli.
- Bassa reattività: non reagisce facilmente con l’ossigeno, ma si ossida in presenza di zolfo formando il caratteristico strato di solfuro d’argento (Ag₂S).
- Formazione di leghe preziose: si combina facilmente con rame e oro per creare leghe utilizzate in gioielleria, monete e componenti elettronici.
A differenza dei metalli alcalini, più reattivi, i metalli di transizione come l’argento sono più stabili e presentano una maggiore varietà di composti, spesso colorati, utilizzati in pigmenti e catalizzatori.
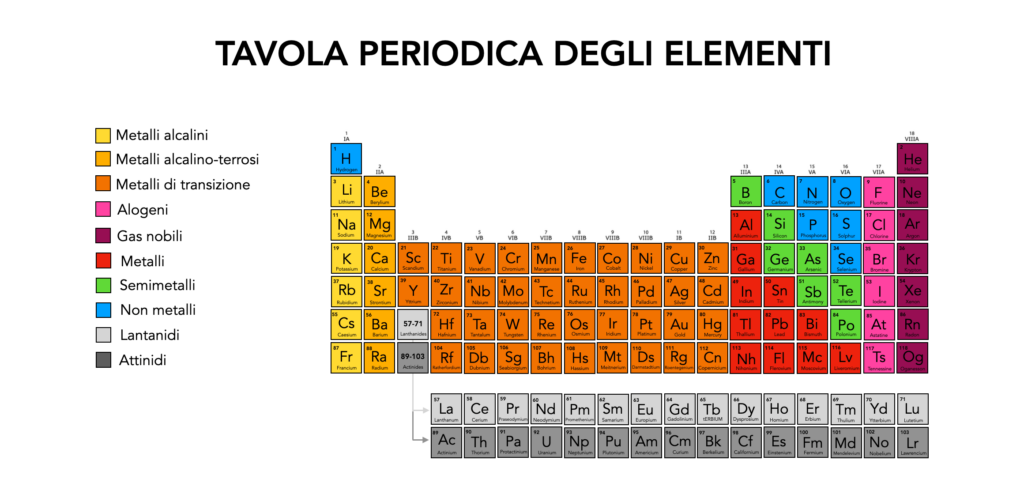
I metalli di transizione: cosa sono
I metalli costituiscono la maggior parte degli elementi nella tavola periodica e si distinguono per proprietà come elevata conducibilità elettrica e termica, malleabilità e lucentezza. Sono suddivisi in diverse categorie, tra cui metalli alcalini, alcalino-terrosi, di transizione, post-transizione e metalli delle terre rare. Ogni gruppo ha caratteristiche chimiche specifiche che determinano il loro comportamento e le loro applicazioni industriali.
I metalli di transizione sono gli elementi situati nei gruppi dal 3 al 12 della tavola periodica. Sono caratterizzati dalla presenza di elettroni negli orbitali d incompleti, il che consente loro di assumere diversi stati di ossidazione e di formare composti stabili e colorati.
Grazie alla loro elevata resistenza, duttilità e capacità di catalizzare reazioni chimiche, questi metalli sono ampiamente utilizzati in leghe, elettronica e processi industriali. Alcuni esempi di metalli di transizione includono ferro (Fe), rame (Cu), argento (Ag) e oro (Au).
Leggi di più sui metalli della tavola periodica
Argento nella Tavola Periodica: informazioni atomiche e di gruppo
Quando osserviamo l’argento nella tavola periodica, possiamo ricavare diverse informazioni chiave sulla sua struttura atomica e chimica:

- Numero atomico: 47
Il numero atomico dell’argento è 47, il che significa che un atomo di argento contiene 47 protoni nel suo nucleo. In condizioni normali, ha anche 47 elettroni, distribuiti nei vari livelli energetici. Questo valore è cruciale perché determina l’identità chimica dell’elemento e il suo comportamento nelle reazioni chimiche.
- Massa atomica: circa 107,87 u
La massa atomica dell’argento è approssimativamente 107,87 unità di massa atomica (u). Questo valore rappresenta la media ponderata delle masse degli isotopi naturali dell’argento. I due isotopi più comuni, Ag-107 e Ag-109, sono entrambi stabili e costituiscono la quasi totalità dell’argento presente in natura.
- Gruppo: 11
L’argento fa parte del gruppo 11, noto anche come il gruppo dei metalli di moneta, insieme a rame (Cu) e oro (Au). Gli elementi di questo gruppo condividono la capacità di condurre elettricità con estrema efficienza e la tendenza a formare legami metallici forti, che li rendono ideali per applicazioni elettroniche e decorative.
- Periodo: 5
Essendo nel periodo 5, l’argento possiede cinque livelli energetici di elettroni. Gli elementi di questo periodo mostrano una transizione da proprietà metalliche più leggere (come il rubidio) a metalli più densi e meno reattivi, come l’argento stesso.
- Configurazione elettronica: [Kr] 4d¹⁰ 5s¹
La configurazione elettronica dell’argento è [Kr] 4d¹⁰ 5s¹, indicando che l’elettrone più esterno si trova nel livello 5s. Questo elettrone di valenza è responsabile della capacità dell’argento di formare legami chimici. Nonostante la presenza di un solo elettrone esterno, l’argento è relativamente stabile e poco reattivo grazie al completo riempimento del livello 4d.
Storia e curiosità sull’argento
La storia dell’argento è antica quanto la civiltà stessa. È stato utilizzato per millenni per monete, gioielli, strumenti rituali e oggetti decorativi, grazie alla sua duttilità e bellezza. I primi ritrovamenti di manufatti in argento risalgono a oltre 5.000 anni fa, con testimonianze della sua estrazione già in Mesopotamia e nell’antico Egitto.
Etimologia del termine
L’argento è conosciuto come uno dei primi metalli ad essere stato lavorato dall’uomo. La sua denominazione è rimasta pressoché invariata nelle varie lingue europee, e questa è la sua origine.
Il nome “argento” deriva dal termine latino argentum, a sua volta proveniente dal greco argyros, che significa “bianco splendente” o “lucente“. Questa radice linguistica riflette la principale caratteristica estetica di questo metallo: il suo colore brillante e la capacità di riflettere la luce.
Antichità: il metallo prezioso delle civiltà antiche
Le civiltà antiche consideravano l’argento un metallo prezioso, al pari dell’oro. Gli egizi lo utilizzavano per creare ornamenti e oggetti sacri, mentre i greci e i romani lo impiegavano principalmente per la coniazione di monete. Le miniere della Spagna e della Grecia erano tra le principali fonti di estrazione di questo metallo nel mondo antico.
L’argento era associato alla luna e alla dea Artemide per la sua lucentezza e purezza. In molte culture, era considerato un metallo sacro con proprietà protettive, e veniva utilizzato in talismani e amuleti.
Medioevo: simbolo di ricchezza e potere
Durante il Medioevo, l’argento divenne uno degli elementi fondamentali dell’economia europea. Regni e imperi coniavano monete d’argento per facilitare il commercio e stabilizzare le economie. Il metallo era così prezioso che intere spedizioni vennero finanziate per cercare nuove miniere.
L’argenteria divenne un simbolo di ricchezza e nobiltà. Famiglie aristocratiche possedevano piatti, bicchieri e posate in argento come segno di status. Inoltre, la scoperta delle Americhe nel XV secolo portò alla massiccia estrazione di argento dalle miniere del Perù e del Messico, aumentando enormemente la disponibilità del metallo in Europa.
L’argento nel mondo moderno: dall’industria alla tecnologia
Con l’avanzare della scienza e della tecnologia, l’argento ha trovato applicazioni ben oltre la gioielleria e la monetazione. Nel XIX e XX secolo, è stato ampiamente utilizzato nella fotografia, grazie alla scoperta della sensibilità alla luce dei composti di argento. Oggi, il metallo è essenziale per l’industria elettronica, la medicina e persino l’energia solare, grazie alla sua elevata conducibilità elettrica e termica.
Caratteristiche e proprietà dell’argento
L’argento, grazie alle sue peculiarità chimiche e fisiche, si presenta come un metallo dallo straordinario impiego in numerosi settori, dall’elettronica alla gioielleria, fino alla produzione di monete e nella fotografia. Ma quali sono le sue caratteristiche?
Posizione nella tavola periodica: significato e proprietà che ne derivano
L’argento occupa la posizione 47 nella tavola periodica, collocandosi nel gruppo 11 (precedentemente noto come IB) e nel periodo 5. La sua posizione determina diverse delle sue proprietà chimiche e fisiche:
- Metallo del gruppo 11. Condivide con i suoi simili nel gruppo, come il rame e l’oro, una configurazione elettronica caratterizzata da un singolo elettrone nel livello di valenza, il che lo rende in grado di formare facilmente cationi positivi (Ag⁺).
- Posizione nel periodo 5. Essendo un metallo di transizione, l’argento presenta una densità elevata, una resistenza meccanica superiore e una buona stabilità termica.
Proprietà fisiche dell’argento
- Elevata densità e lucentezza. Con una densità di 10,49 g/cm³, l’argento è significativamente più pesante di molti altri metalli, ma la sua lucentezza e riflettività lo rendono particolarmente prezioso in ambito estetico e decorativo.
- Resistenza alla corrosione. L’argento non si ossida facilmente in condizioni normali, ma è suscettibile alla formazione di solfuri, che conferiscono una patina scura alla superficie, specialmente in ambienti ricchi di zolfo.
- Eccellente conducibilità elettrica e termica. L’argento è il miglior conduttore di elettricità e calore tra i metalli, il che lo rende fondamentale in applicazioni elettroniche, circuiti e contatti elettrici.
- Malleabilità e duttilità. L’argento può essere facilmente forgiato in fili sottili e lavorato in forme complesse, rendendolo ideale per la gioielleria e altre applicazioni industriali.
- Punto di fusione relativamente alto. Con un punto di fusione di 961,8°C, l’argento resiste bene alle alte temperature, ma risulta comunque facilmente lavorabile in fusione.
Proprietà chimiche dell’argento
- Reattività con l’ossigeno. A temperatura ambiente, l’argento non forma facilmente ossidi, ma reagisce con composti contenenti zolfo, formando solfuri di argento che possono annerire la superficie.
- Formazione di leghe. L’argento è frequentemente combinato con rame e altri metalli per formare leghe come l’argento sterling, migliorando la durezza e la resistenza alla corrosione.
- Reattività con acidi e basi. L’argento è resistente agli acidi deboli, ma può reagire con acidi forti, come l’acido azotico, per formare sali d’argento come il nitrato d’argento (AgNO₃).
- Processo di galvanizzazione. L’argento può essere utilizzato nel processo di placcatura per migliorare l’aspetto e la conduttività di altri materiali, grazie alla sua alta riflettività e resistenza alla corrosione.
L’atomo di argento
La struttura atomica dell’argento è essenziale per comprendere molte delle sue proprietà chimiche e fisiche. L’argento, come ogni altro elemento chimico, è costituito da atomi, che sono a loro volta formati da particelle subatomiche: protoni, neutroni ed elettroni. Esaminiamo più dettagliatamente come queste particelle sono organizzate e come influiscono sul comportamento dell’argento.
Nucleo atomico
Il nucleo di un atomo di argento contiene 47 protoni, insieme a neutroni che possono variare a seconda degli isotopi. L’isotopo più comune dell’argento è l’Ag-107, che ha 60 neutroni, ed è stabile. Un altro isotopo abbondante è l’Ag-109, che ha 62 neutroni.
Un isotopo è una variante di un elemento chimico che ha lo stesso numero di protoni ma un numero diverso di neutroni nel nucleo. Questo porta a una diversa massa atomica, ma le proprietà chimiche rimangono generalmente invariabili.
Distribuzione degli elettroni
La disposizione degli elettroni nell’atomo di argento segue le regole di riempimento dei livelli energetici secondo il principio di Aufbau. Poiché l’argento ha 47 elettroni, la sua configurazione elettronica completa è la seguente:
- K-sottolivello (1° livello): 2 elettroni
- L-sottolivello (2° livello): 8 elettroni
- M-sottolivello (3° livello): 18 elettroni
- N-sottolivello (4° livello): 18 elettroni
- O-sottolivello (5° livello): 1 elettrone
La configurazione elettronica dell’argento è quindi: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4d¹⁰ 5s¹.
Gli elettroni di valenza dell’argento si trovano nel livello 5s¹ e 4d¹⁰. Questi elettroni di valenza sono cruciali, poiché partecipano alle reazioni chimiche e alla formazione di legami con altri atomi, conferendo all’argento le sue proprietà caratteristiche.
Configurazione cristallina
L’argento, come molti metalli, cristallizza in una struttura cubica a facce centrate (FCC), una delle più stabili e comuni. In una struttura FCC, ogni atomo di argento è circondato da 12 atomi vicini, il che conferisce un’alta malleabilità e duttilità. Questa disposizione facilita la deformazione plastica, permettendo agli atomi di muoversi relativamente facilmente gli uni rispetto agli altri senza rompersi. Di conseguenza, l’argento è particolarmente adatto per applicazioni in cui è necessaria una lavorazione fine, come la gioielleria.
Energia di ionizzazione e affinità elettronica
L’energia di ionizzazione rappresenta l’energia necessaria per rimuovere un elettrone da un atomo neutro.
L’argento ha una prima energia di ionizzazione relativamente bassa (circa 731 kJ/mol), il che significa che è facilmente in grado di cedere il suo elettrone di valenza. Questo comportamento è alla base della tendenza dell’argento a formare cationi Ag⁺ nelle reazioni chimiche, come avviene frequentemente nei processi di ossidazione.
L’affinità elettronica, che misura l’energia liberata quando un atomo acquisisce un elettrone, è moderatamente bassa per l’argento.
Ciò indica che l’argento non è incline ad acquisire elettroni per formare anioni stabili, ma preferisce cedere il suo elettrone di valenza, comportandosi così come un metallo che tende a donare elettroni piuttosto che ad acquistarli.
Raggio atomico e legami chimici
L’argento ha un raggio atomico di circa 144 pm, che lo colloca tra i metalli di transizione, con un raggio maggiore rispetto ai metalli di gruppo 1, ma più contenuto rispetto ai metalli di transizione più pesanti. Questo raggio atomico e la sua configurazione elettronica conferiscono all’argento caratteristiche particolari nella formazione di legami chimici.
L’argento forma principalmente legami metallici con altri atomi di argento. In questa configurazione, gli elettroni di valenza sono condivisi liberamente tra gli atomi, conferendo al metallo le sue proprietà di conducibilità elettrica e termica. L’argento forma anche legami ionici con altri elementi non metallici come gli alogeni (ad esempio, il cloro), cedendo facilmente il suo elettrone di valenza per formare ioni Ag⁺. Un esempio di composto ionico è il cloruro d’argento (AgCl), che è insolubile in acqua ed è usato in molte applicazioni industriali e nella fotografia.


Usi e applicazioni dell’argento
L’argento è un metallo dalle proprietà eccezionali, ampiamente utilizzato in vari settori grazie alla sua conducibilità elettrica, resistenza alla corrosione e versatilità. Di seguito vengono descritti alcuni degli usi più rilevanti dell’argento:
Settori che utilizzano l’argento:
- Elettronica e tecnologia. Grazie alla sua eccellente conduttività elettrica, l’argento è utilizzato in numerosi componenti elettronici, come circuiti integrati, connettori e sensori. È anche impiegato in dispositivi tecnologici avanzati come smartphone e computer.
- Fotografia e ottica. L’argento è stato a lungo un materiale fondamentale nella fotografia tradizionale, dove veniva usato in pellicole e carte fotosensibili. Inoltre, grazie alla sua riflettività, l’argento è utilizzato in telescopi e specchi per apparecchiature ottiche.
- Industria automobilistica e aerospaziale. L’argento è utilizzato in piccole quantità in veicoli e aeromobili, grazie alla sua conduttività e resistenza alla corrosione, per applicazioni come i contatti elettrici e i cavi.
- Gioielleria e arredamento. L’argento è un materiale pregiato per la creazione di gioielli e articoli da regalo, grazie alla sua lucentezza e lavorabilità. È anche utilizzato per realizzare oggetti di arredo e utensili da cucina di alta qualità.
- Energia rinnovabile. L’argento è impiegato nelle celle solari per migliorare l’efficienza energetica, grazie alle sue proprietà riflettenti e conduttive. È un elemento chiave nei pannelli fotovoltaici, dove migliora la trasmissione dell’elettricità.
Alcune curiosità sull’argento
- Un tempo era una moneta. Sebbene oggi l’argento sia un materiale abbondante e utilizzato in molteplici ambiti, nel passato era considerato un metallo molto pregiato. In epoche storiche, veniva utilizzato per coniare monete, ma anche per ornamenti e gioielli destinati a nobili e monarchi. Addirittura, in epoca romana, l’argento era considerato uno status symbol.
- Proprietà antibatteriche. L’argento possiede forti proprietà antimicrobiche. Viene utilizzato in ambito medico e sanitario per realizzare dispositivi come cateteri e garze, che approfittano della sua capacità di inibire la crescita di batteri e altri microrganismi. Questo è dovuto alla capacità degli ioni d’argento di interferire con le funzioni vitali delle cellule batteriche.
- Cattura benissimo l’energia solare. Grazie alla sua elevata conduttività elettrica e riflettività, l’argento è utilizzato nei pannelli solari ad alta efficienza. La riflettività dell’argento aiuta a migliorare la raccolta della luce solare, mentre la sua conduttività ottimizza la trasmissione di energia.
- Ricopriva le pellicole fotografiche. L’argento ha avuto un ruolo centrale nella storia della fotografia. Le pellicole fotografiche tradizionali, infatti, erano ricoperte da sali d’argento, che reagivano alla luce per formare l’immagine. Ancora oggi, alcuni fotografi e artisti utilizzano tecniche di stampa a base di argento per ottenere immagini di qualità superiore.
- La chimica lo adora. L’argento è ampiamente utilizzato come catalizzatore in diversi processi chimici, come la produzione di formaldeide. Inoltre, la sua superficie è ideale per riflettere radiazioni, il che lo rende utile anche nelle applicazioni scientifiche come negli acceleratori di particelle.
- Può essere riciclato all’infinito. Uno dei principali vantaggi dell’argento è la sua riciclabilità. A differenza di altri materiali, l’argento può essere riciclato quasi all’infinito senza perdere le sue proprietà. Questo ne fa un materiale fondamentale in un’ottica di sostenibilità, in quanto il riciclo consente di ridurre l’impatto ambientale e il fabbisogno di estrazione mineraria.




